mEGFP-proteiinin valmistus ja sen hyödynnettävyys Uudet materiaalit ja prosessit -tutkimusryhmän toiminnassa
Vihreää fluoresoiva proteiini eli mEGFP on fluoresoivan ominaisuuden vuoksi mielenkiintoinen proteiini, jota voidaan käyttää mallimolekyylinä biomateriaalipohjaisten lääkeannostelumateriaalien tutkimuksessa ja kehityksessä. Kaupallisesti hankittuna se on melko kallista, minkä vuoksi Uudet materiaalit ja prosessit -tutkimusryhmä haluaa valmistaa tutkimushankkeessa tarvitsemansa mEGFP:n itse. Proteiinin tuotanto- ja puhdistusprosessi on osoittautunut haasteelliseksi, minkä vuoksi opinnäytetyössä kehitettiin toisenlaista valmistustapaa.
Uudet materiaalit ja prosessit -tutkimusryhmä ja sen tavoitteet
Uudet materiaalit ja prosessit on Turun ammattikorkeakoulun tutkimusryhmä. Tutkimusryhmä toimii materiaali- ja prosessiosaamisen kehittämisympäristönä tukien opetusta, tehden tutkimusta ja yhteistyötä yritysten kanssa paikallisesti sekä kansainvälisesti. Tutkimusryhmän toiminta on yhdistetty opetukseen painottuen 3. ja 4. vuosien syventäviin opintoihin sekä harjoitteluihin ja opinnäytetöihin. Yhtenä ryhmän tutkimusaiheena on lääkeannostelumateriaalit ja materiaalien vapautumistesteissä tarvitaan mallimolekyylejä. Tutkimusryhmä valmistaa mEGFP-proteiinia mallimolekyyliksi havainnollistamaan hydrogeelien ominaisuuksia. Kaupallisesti hankittu mEGFP on melko kallista ja tutkimuksessa sitä tarvitaan suurehkoja määriä, minkä vuoksi olisi hyödyllistä valmistaa sitä itse. Proteiinia (mEGFP) on aiemmin yritetty valmistaa syventävien opintojen laboratoriotöissä, mutta se on osoittautunut haasteelliseksi. Ongelmia on ollut etenkin puhdistamisen kanssa ioninvaihtokromatografialla, sillä proteiini ei ole kiinnittynyt kunnolla pylvääseen. Opinnäytetyössä kehitetyllä menetelmällä voidaan tuottaa histidiinihännällistä mEGFP-yhdistelmäproteiinia, joka voidaan puhdistaa tehokkaammalla affiniteettikromatografialla. Menetelmälle laadittiin myös työohjeet, joita voidaan jatkossa hyödyntää syventävien opintojen laboratoriotöissä.
Mikä on mEGFP?
mEGFP on yksi GFP:n eli vihreää fluoresoivan proteiinin variaatio. Fluoresoivat proteiinit emittoivat niiden nimessä mainitun väristä fluoresenssivaloa virittyessään sinisestä tai UV-valosta. EGFP on paranneltu versio GFP:stä ja mEGFP on siitä monomeerinen versio. Monomeerisyys on ratkaisu fluoresenssiproteiinien taipumukseen muodostaa dimeereitä. Dimeerit johtavat polymerisoitumiseen, mikä voi muuttaa proteiinin toimivuutta.
Mikä on yhdistelmäproteiini?
Yhdistelmäproteiini on yhdistelmä-DNA:sta tuotettu proteiini. Yhdistelmä-DNA on puolestaan nimitys sellaiselle DNA:lle, joka on valmistettu yhdistämällä DNA-fragmentteja eri lähteistä. Nykyisin suurin osa yhdistelmäproteiineista on fuusioproteiineja eli proteiineja, joihin on yhdistetty eri geenien koodaamia proteiinihäntiä. Proteiinihäntien avulla voidaan muun muassa tehostaa yhdistelmäproteiinien puhdistamista sekä helpottaa kohdeproteiinin havaitsemista esim. solussa. Kuuden histidiiniaminohapon muodostama häntä on yleisesti käytetty affiniteettiin perustuvassa proteiinipuhdistuksessa. Se mahdollistaa yhdistelmäproteiinin puhdistamisen standardisoidulla menetelmällä affiniteettikromatografialla.
Yhdistelmä-DNA:n valmistus
Jotta saadaan valmistettua yhdistelmäproteiinia, täytyy siis ensin valmistaa sitä koodaava yhdistelmä-DNA. Opinnäytetyössä valmistettiin yhdistelmä-DNA alakloonauksella eli restriktiodigestiota hyödyntävällä kloonausmenetelmällä. Sen vaiheet on kuvattu alla olevassa prosessikaaviossa (kaavio 1).
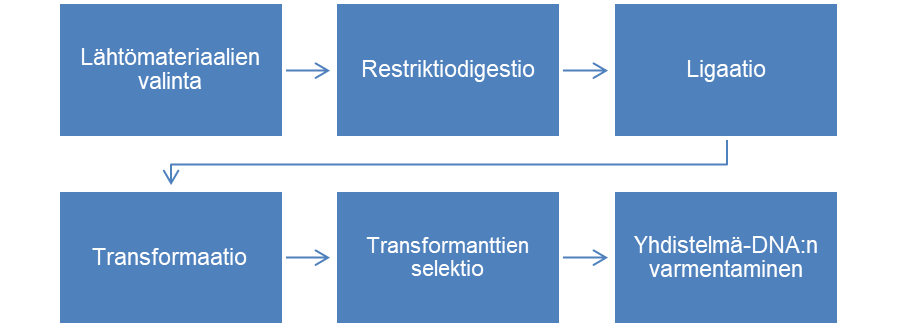
Lähtömateriaaleja ovat insertti, joka on kloonattava DNA sekä vektori eli rengasrakenteinen plasmidi-DNA, johon insertti liitetään. Lisäksi tarvitaan isäntäsolut, joihin yhdistelmä-DNA siirretään ja, joiden avulla ilmennetään yhdistelmäproteiinia. Opinnäytetyössä inserttinä käytettiin mEGFP-geenin DNA-jaksoa, jota monistetaan PCR-menetelmällä mEGFP-pRK5-vektorista. Alukepareissa on mukana restriktioentsyymien tunnistuskohta restriktiodigestiota varten. Vektorina käytettiin puolestaan pET32b(+)-plasmidia. Kyseisessä plasmidissa on valmiiina histidiinihäntää koodaava geeni, joka tuottaa yhdistelmäproteiiniin halutun histidiinihännän. Isäntäsoluina käytettiin NEB T7 Express E. coli -soluja, jotka tutkimusryhmä on todennut toimiviksi..
Aluksi insertti ja vektori tehdään yhteensopiviksi restriktiodigestiolla, jonka jälkeen ne saadaan liitettyä toisiinsa ligaatiolla. Tällöin muodostuu yhdistelmä-DNA, joka siirretään isäntäsoluihin transformaatiolla. Opinnäytetyössä transformaatio tehtiin elektroporaatiolla. Transformaation jälkeen soluista erotellaan transformantit eli transformoituneet solut ja selvitetään ovatko ligaatio ja transformaatio ylipäätään onnistuneet. Selektio tehtiin ampisilliiniresistenssin avulla siten, että vain transformoituneet solut ovat ampisilliinille resistenssejä ja täten kasvavat antibioottia sisältävällä kasvatusmaljalla toisin kuin muut solut. Ligaation ja transformaation onnistuminen selvitetään tarkastelemalla maljoja. Jos yhdistelmä-DNA:n maljalla on selvästi enemmän pesäkkeitä kuin negatiivisen kontrollin maljalla ovat ligaatio ja transformaatio onnistuneet. Lopuksi vielä varmennetaan, että transformanteissa on oikeanlainen yhdistelmä-DNA. Opinnäytetyössä se tehtiin diagnostisella restriktiodigestiolla. Siinä DNA:lle tehdään katkaisureaktio restriktioentsyymeillä, jonka jälkeen reaktiotuotteet ajetaan agaroosigeelille. Opinnäytetyössä restriktiodigestio tehtiin samoilla entsyymeillä, joita käytettiin insertin ja vektorin yhteensovittamisessa. Agaroosigeeliä tarkastelemalla nähdään, onko DNA:ssa oikeankokoiset vektori ja insertti.
Yhdistelmäproteiinin tuottaminen ja puhdistus
Yhdistelmäproteiineja ilmennetään eli tuotetaan erilaisilla ilmentämisjärjestelmillä, joissa hyödynnetään isäntäsoluja. Kasvattamalla isäntäsoluja sopivissa olosuhteissa ne tuottavat yhdistelmäproteiinia solujen sisällä olevan yhdistelmä-DNA:n koodin mukaisesti. Opinnäytetyössä mEGFP-yhdistelmäproteiinia tuotettiin NEB T7 Express E. coli -soluilla. Puhdistuksen tarkoituksena on erottaa haluttu proteiini muista proteiineista. Opinnäytetyössä puhdistuksessa hyödynnettiin histidiinhäntää, jonka ansiosta voitiin hyödyntää kiinteän faasin metalli-ioniaffiniteetti kromatografia -tekniikkaa (Immobilized Metal ion Affinity Chromatography, IMAC).
Puhdistus paremmaksi IMAC-tekniikalla
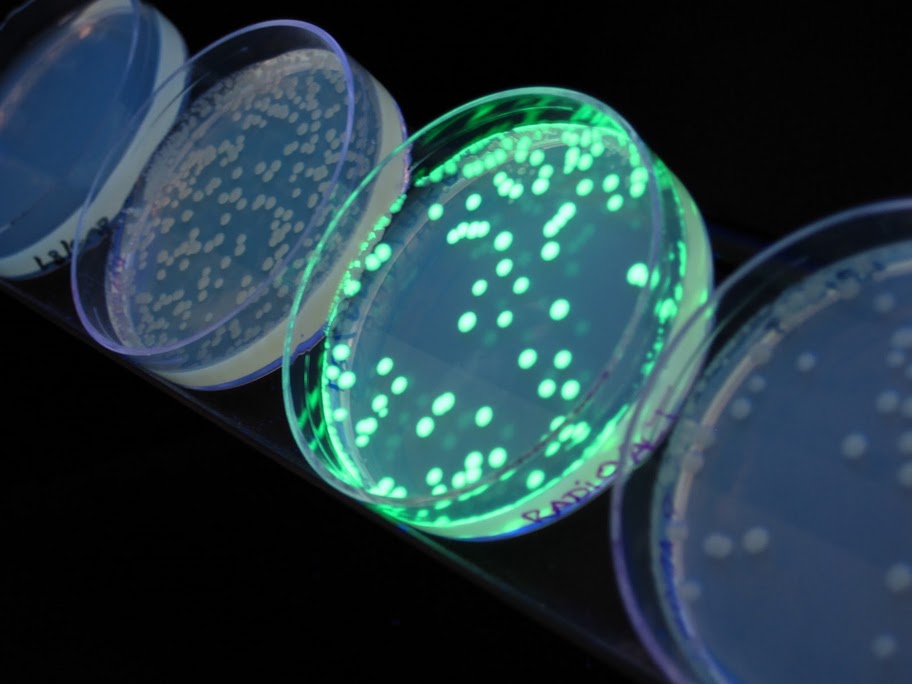
Opinnäytetyöntavoitteena oli parantaa mEGFP proteiinin puhdistusmenetelmää aikaisempaan verrattuna. Aiemmin puhdistus tehtiin ioninvaihtokromatografialla eikä proteiini kiinnittynyt kunnolla pylvääseen. Opinnäytetyössä kehitettiin yhdistelmä-DNA-rakenne, joka tuottaa histidiinihännällisen mEGFP-fuusioproteiinin ja se voidaan tehokkaasti puhdistaa Ni-Sepharose matriisin avulla IMAC-tekniikalla. Puhdistus saatiin onnistumaan paremmin, sillä proteiini kiinnittyi pylvääseen selkeänä vihreänä viivana, kuten alla olevasta kuvasta näkyy (kuva 1). Myös mEGFP-fuusioproteiinin irrotus eli eluointi puhdistuspylvään matriisista onnistui ja kohdeproteiini tuli ulos pylväästä yhtenäisenä rintamana pienessä tilavuudessa, mikä havaittiin kromatogrammissa terävä eluointipiikkinä.

Mitä seuraavaksi?
Opinnäytetyössä pääpainona oli valmistaa yhdistelmä-DNA:ta ja laatia sitä varten työohjeet. Ilmentäminen ja puhdistus tehtiin yhdistelmä-DNA:n toimivuuden varmistamiseksi. Jatkossa tuleekin keskittyä näiden vaiheiden kehittämiseen siten, että saataisiin mahdollisimman puhdasta mEGFP-proteiinia hyvällä saannolla.
Lähteet:
Davidsson M. 2022, Histidiinihännällisen mEGFP-yhdistelmäproteiinin tuottaminen mikrobisoluilla : yhdistelmä-DNA:n valmistaminen ja testaaminen sekä yhdistelmäproteiinin varmentaminen – Theseus, Turun ammattikorkeakoulun opinnäytetyö.