Puhdastilojen desinfiointi lääketeollisuudessa – potilasturvallisuuden varmistaminen tuotantoprosessin aikana
Alana lääketeollisuudella on merkittävä rooli yhteiskunnassa ja tuotteilla suuret vaatimukset niiden riskialttiiden käyttötarkoituksien myötä. Lääkkeiden tai lääkinnällisten laitteiden laadunvarmistuksessa niin tuotteen tarkoituksenmukaisen toiminnan varmistaminen on oleellista, kuin myös ei-toivottujen yhdisteiden tai mikro-organismien pääsy tuotteeseen on estettävä.
Quality by Design
Laadukkaan tuotteen valmistaminen alkaa jo suunnitteluvaiheesta. Useilla teollisuuden aloilla käytetty Quality by Design menettelytavan tavoitteena on tuottaa ennalta määriteltyjen kriteerien mukainen tuote ensiyrittämällä tieteellisiin menetelmiin perustuvalla huolellisella suunnittelulla, kehitystyöllä ja tuotantoprosessilla. Perusperiaatteena toimii idea, että tuotteesta ei saada laadukasta testaamalla, vaan laatu luodaan tuotteeseen alusta alkaen. Kokonaisuudessaan työ koostuu muun muassa itse tuotantoprosessin ja tuotantotilojen perinpohjaisesta suunnittelusta, riskiarvioinnin laatimisesta, kaikkien mahdollisten vaihtelutekijöiden lähteiden tunnistamisesta ja erinäisten analyysimenetelmien käytöstä toiminnan arvioinnissa. (European Medicines Agency n.d.)
Riskien minimoiminen
Puhdastilatyöskentely on yleinen tapa varmistaa turvallisen ja laadukkaan tuotteen valmistusprosessi. Tuotteen luonteesta riippuen joillekin voidaan suorittaa niin sanottu loppusterilointi, jossa valmiista lopullisessa pakkauksessaan olevasta tuotteesta voidaan prosessin lopuksi vielä tuhota mahdollista kontaminaatiota aiheuttavat mikrobit esimerkiksi etyleenioksidilla. Kaikille tuotteille tätä ei ole mahdollista tehdä ja usein tuotanto tapahtuu puhdastiloissa kontaminaatioriskiä minimoiden, vaikka loppusterilointi tehtäisiinkin. Kontaminantteihin sisältyy tartuntavaarallisten mikrobien lisäksi muun muassa eräiden bakteerien tuottamat myrkkyaineet, jonka vuoksi kontaminaation ehkäisy koko prosessin ajan on oleellista.
Oleellinen osa kontaminaationhallintaa on tuotantotilojen olosuhteiden valvonta. Tilojen hiukkasmäärän ja mikrobikontaminaation ollessa raja-arvojen sisällä riski tuotteen kontaminoitumiselle on hyvin alhainen. Tuotantotilojen puhtaustaso on siis suoraan yhteydessä tuotteen laatuun ja siten myös potilasturvallisuuteen. Tason saavuttamiseksi ja ylläpitämiseksi tarvitaan tilojen suunnittelun eli rakennusteknisten ratkaisujen lisäksi vaatimusten mukaiset siivous- ja desinfiointimenettelyt sekä säännöllistä olosuhdevalvontaa.
Bioburden – mikrobitaakka
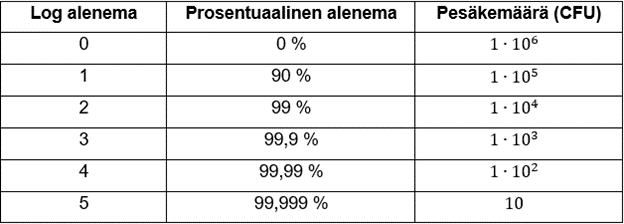
Desinfiointi määritelmänä tarkoittaa mikrobien määrän vähentämistä tasolle, joka ei aiheuta tartuntavaaraa tai kontaminaatioriskiä tuotteelle. Euroopan komission GMP-asetuksen (2022) Annex 1 määrittelee vaatimukset lääkinnällisten tuotteiden valmistukselle, mukaan lukien käytettävien desinfiointimenetelmien ja -aineiden edellytykset. Edellytyksiin kuuluvat kirjallinen toimintaohje puhdastilojen desinfiointimenettelylle, vähintään kahden eri toimintaperiaatteen desinfiointiainetta, säännöllisin väliajoin käytettävä itiövaikutteinen aine, käytetyt menetelmät ja aineet ovat validoituja sekä niiden tehoa arvioidaan olosuhdevalvonnan ja trendiseurannan avulla. Testauksessa määritetty alkukontaminaatio eli bioburden tulee olla sallituissa rajoissa valmistettavan tuotteen mikrobiologisen laadun takaamiseksi.
Desinfiointimenetelmät voidaan jakaa fysikaalisiin ja kemiallisiin menetelmiin. Fysikaalisiin kuuluvat lämpö, säteily ja suodatus, jotka soveltuvat parhaiten välineiden ja nesteiden desinfiointiin. Kemiallisia menetelmät ovat ensisijaisena puhdastilojen ilman ja pintojen desinfioinnissa. Desinfiointi voidaan suorittaa esimerkiksi sumuttamalla tila tai manuaalisesti pyyhkimällä pinnat soveltuvalla aineella. Käytettävästä aineesta riippuen mahdolliset desinfiointiainejäämät tulee poistaa tai neutraloida pinnoilta käsittelyn jälkeen. Oleellisena osana desinfiointiprosessia on huolellinen siivous ennen desinfiointia ja tilanteesta riippuen myös jälkeen jäämien poistamiseksi. Kemiallisista desinfiointiaineista vetyperoksidi on puhdastilojen desinfioinnissa yleisesti käytetty sen jäämättömän lopputuloksen vuoksi.
Kemiallisten tehoaineiden luokittelu (Friman, T. & Kivisalmi, V. 2015)
- Alkoholit
- Halogeenit
- Fenoliyhdisteet
- Peroksygeenit eli hapettavat yhdisteet
- Aldehydit
- Tensidit
- Polymeeriset biguanidit
Euroopassa biosidivalmisteita valvotaan ja tehoaineilla on oltava EU:n biosidiasetuksen mukainen hyväksyntä ennen käyttöä tai markkinoille asettamista. Käyttötarkoituksesta ja puhdastilaluokasta riippuen käytettävälle desinfiointimenetelmälle asetetut vaatimuksien täyttyminen tulee varmistaa tieteellisin menetelmin.
Lähteet
Ertman, L. 2023. UVC- ja H₂O₂- desinfiointimenetelmien testaus. Opinnäytetyö (AMK). Turun Ammattikorkeakoulu.
European Medicines Agency. Quality by design. Viitattu 29.3.2023. https://www.ema.europa.eu/en/human-regulatory/research-development/quality-design
European Commission 2022. Guidelines: The Rules Governing Medicinal Products in the European Union, Volume 4 EU Guidelines for Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use. Annex 1: Manufacture of Sterile Medicinal Products. Viitattu 31.3.2023. https://www.gmp-compliance.org/files/guidemgr/20220825_gmp-an1_en_0.pdf
Friman, T. & Kivisalmi, V. 2015. Laboratorion välinehuolto. 1. painos. Saarijärvi: Saarijärven Offset.