
Lääkinnällisten laitteiden lisäävä valmistus – Mitä tutkijan ja valmistajan on hyvä tietää?
Lääkinnällisillä laitteilla tarkoitetaan terveydenhuollon laitteita ja tarvikkeita jotka ovat instrumentteja, laitteistoja ja vastaavia tarvikkeita, joita valmistaja määrittelee käytettäviksi esimerkiksi ihmisten sairauden diagnosoinnissa, ehkäisyssä, tarkkailussa, hoidossa tai sairauden lievityksessä.
Lisäävä valmistus – tai 3D-tulostus – on kehittyvä teknologia, jolla on paljon potentiaalia lähitulevaisuudessa, esimerkiksi talojen rakentamisessa, varaosien valmistuksessa ja otsikkoon liittyen lääkinnällisten laitteiden valmistuksessa. 3D-tulostettavat lääkinnälliset laitteet ovat täynnä potentiaalia potilaiden hoitoja silmälläpitäen. Esimerkkinä ovat potilaille personoidut hoidot ja implantit, lääkkeensyöttölaitteet ja tulevaisuudessa jopa solukasvatetut ja tulostetut varaelimet, luut yms. Opinnäytetyössä käydään läpi 3D-tulostettavien lääkinnällisten laitteiden olemassaolevia regulaatioita eri maissa ja ennusteita tuleville regulaatiomuutoksille. Lisäksi työssä selvitetään asioita, joita on hyvä tietää, kun kehitetään ja valmistetaan 3D-tulostettuja laitteita.
Työn tilaajana toimi AMBioPharma-hanke
Opinnäytetyö on tehty AMBioPharma eli Lisäävän valmistuksen keskus bio- ja lääketeollisuudelle -hankkeelle. AMBioPharma on määritelty yhdeksi Varsinais-Suomen tärkeimmistä erikoistumisen painopisteistä, jonka tavoitteena on lisätä ja luoda yhteistyötä sekä innovaatiota tutkimuskeskusten ja kaupallisten yritysten välillä. Tässä hankkeessa painotetaan 3D-tulostuksen eli lisäävän valmistuksen tutkimista ja tuotantotarpeita niiden nousevan trendin vuoksi, sekä 3D-tulostuksen nopeaa kehittämismahdollisuutta Varsinais-Suomessa. (Åbo Akademi University n.d.)
Hankkeen päätavoitteita ovat:
- Edistää ja nopeuttaa yritysten tuotekehitystä uusien lääkevalmisteiden, hammasproteesien, lääkinnällisten instrumenttien ja in vitro-diagnostiikan testijärjestelmiä
- Korostaa lisäävän valmistuksen merkitystä osana uusien tuotekehitysprojektien innovointia Varsinais-Suomen bio- ja lääketeollisuudessa, sekä nostaa yritysten innovaatiokykyä ja liikevaihtoa lyhyessä ajassa.
- Kasvattaa lisäävän valmistuksen käyttöä yritysten tuotekehitystoiminnassa ja tuotantolaitteistona.
- Monipuolistaa materiaalien käyttöä, joka johtaa uusien tuotteiden kehittämiseen.
- Kasvattaa yhteistyötä 3D-tulostuslaitteistoja kehittävien ja valmistavien yritysten sekä bio- ja lääkealan eri sektoreiden välillä sekä nostattaa 3D-tulostuksen osaamistasoa.
(Åbo Akademi University n.d.)
Lisäävä valmistus / 3D tulostaminen
Lisäävä valmistus käsittelee opinnäytettyössä pääosin tapaa tulostaa tuotteita kerros kerrallaan niin, että tulostuslaite kiinteyttää halutun materiaalin pieni siivu kerrallaan laitteen noustessa tai laskiessa samalla, kun tulostuspää valmistaa uuden kerroksen aikaisemman päälle.
Lääkinnällisten laitteiden kehittämisessä 3D-tulostimet ja niillä valmistettavat laitteet ovat yksi nousevassa suosiossa olevista teknologioista johtuen edullisten ja helpommin saatavissa olevien tulostimien tulosta markkinoille. Tutkijat ja valmistajat voivat vähentää kustannuksia ja aikaa tuodakseen markkinoille lääkinnällisiä laitteita, joita he itse 3D-tulostavat. Valmistusta ei enää tarvitse ulkoistaa toiselle yritykselle, jolla on välineet tietynlaisen lääkinnällisen laitteen tuotantoon (Formlabs. n.d.).
Esimerkkejä 3D-tulostettavista lääkinnällisistä laitteista ovat hammasproteesit, henkilökohtaiset hammasmallinnukset ja oikomiseen tarkoitetut välineet. Muita laitteita ovat personoidut kuulolaitteet, proteesit (jalka- tai käsi-, yms.), biohajoavat implantit sekä erikoiset leikkausinstrumentit. (Formlabs n.d.)
EU:n, U.S.:n ja joidenkin muiden maiden regulaatiot
Opinnäytetyön pääasiallinen aihe on kartoittaa erilaiset olemassa olevat regulaatiot 3D-tulostettaville lääkinnällisille laitteille ja miten ne ovat päivittymässä lähivuosina, ensisijaisesti koskien tutkimusta ja valmistusta EU:n ja U.S. alueilla.
Yleisesti ottaen on tärkeää, että 3D-tulostettaville lääkinnällisille laitteille, kuten muillekin lääkinnällisille laitteille, on regulaatioita sekä säädöksiä potilasturvallisuuden ja laadun turvaamiseksi. Tämä luo lisää luottamusta laitemarkkinoille.
Joka maalla on oma lääkinnällisistä laitteista vastaava regulaatio-organisaatio. EU:ssa on yleisesti EMA-johteinen regulaatioelin, joka tekee yhteistyötä eri Euroopan maiden kanssa, jotta saataisiin aikaan yhtenäiset regulaatiot EU:n alueella. EU:n alueella on myös käynnissä hyvin tärkeä regulaatiopäivitys työn kirjoittamisen aikaan. Siinä päivitettiin vuonna 1993 julkaistu Medical Device Directive (MDD) uudeksi, vuonna 2017 käyttöön tulleeksi Medical Device Regulation (MDR) regulaatiorungoksi. Samalla myös EU:n vuonna 1998 käyttöön tullut In Vitro Diagnostic Medical Device Directive (IVDD) korvaantui vuonna 2022 uudella In Vitro Diagnostic Medical Devices Regulation (IVDR) regulaatiokehyksellä. Sekä MDR ja IVDR ovat vielä siirtymävaiheessa työn kirjoitusaikana. (EMA n.d.)
U.S.:n alueella oleva Food and Drug Administration (FDA) vastaa lääkinnällisten laitteiden regulaatioista, turvallisuudesta ja toimivuuden seurannasta (mukaan lukien 3D-tulostetut). FDA on myös yleisesti päivittänyt regulaatiokehyksiä ja tarkennuksia varsinkin vuonna 2021 vastaamaan 3D-tulostettavien lääkinnällisten laitteiden tuomaa epävarmuutta säädöksissä ja regulaatioissa. (FDA 2021.)
Lääkinnällisten laitteiden riskiluokitus
Riskiluokitus on tapa, jolla lääkinnällisiä laitteita luokitellaan helposti reguloitavasta hyvin vaikeasti reguloitavaksi, pohjautuen siihen miten ison riskin laite voi aiheuttaa potilaalle käytössä. Yleisesti lääkeainetta sisältävät, kehon sisällä tai leikkausta vaativat lääkinnälliset laitteet automaattisesti saavat isomman riskiluokituksen, koska ne joutuvat potilaan kehon sisälle tai vaativat kehon leikkausta. Tärkeä osa riskiluokitusta on myös, mihin käyttötarkoitukseen lääkinnällistä laite on tarkoitettu, esimerkiksi, onko se tarkoitettu kehon sisäiseen tai ulkoiseen käyttöön ja kompromisoiko laite hengitysteitä, verenkiertoa tai vastaavaa. (Vivek, D ym. 2019.)
Taulukossa 1. Riskiluokitukset ja regulaatioelimet, näkyy esimerkkinä, miten eri maat riskiluokittelevat lääkinnälliset laitteet.
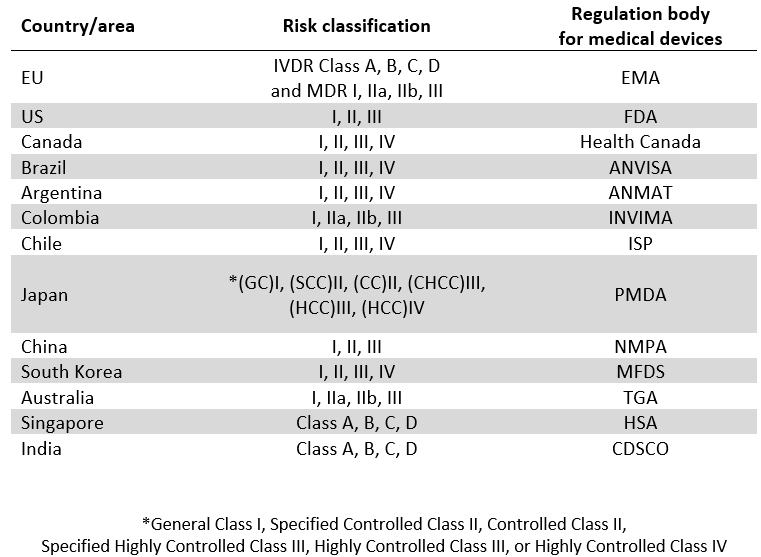
Taulukko 1. Riskiluokitukset ja regulaatioelimet (Vivek, D etc. 2019). Riskitaso kasvaa vasemmalta oikealle, matalasta riskistä korkeaan riskiin. Regulaatiota valvova taho on esitetty lyhenteinä.
Mitä odottaa tulevaksi regulaatioiden osalta
Opinnäytettä kirjoittaessa huomasin trendinä olevan globaali aikomus regulaatioiden harmonisointiin niin, että mahdollisimman moni alue alkaisi käyttämään samoja tai saman kaltaisia riskiluokituksia ja vaatimuksia tutkimuksissa ja lääkinällisten laitteiden valmistuksessa (varsinkin 3D-tulostetut laitteet). Yhteiset säännökset voivat tulevaisuudessa auttaa valmistajia tuotekehittämään laitteitaan sekä laajentamaan regulaatioaluetta ja markkinoita muihin maailman alueille käyttäen vähemmän aikaa ja vaivaa eri alueiden riskiluokituksien ja rekisteröintien erojen tulkintaan. Mitä vähemmän aikaa ja vaivaa laitteen markkinoinnin laajentamiseen käytetään, sitä enemmän valmistaja voi saada voittoa. Tämä madaltaisi kynnystä valmistajille tuoda tuotteitaan useammille markkinoille.
Regulaatioiden päivittämiset ja harmonisointi tulee myös lähitulevaisuudessa lisäämään tiukempia vaatimuksia lääkinnällisille laitteille ja tarkempaa tuote- ja markkinavalvontaa riippuen riskiluokituksista ja tarpeesta. Yksi työkalu halutun toimivuuden ja seurannan lisäämiseksi on yleistyvä Unique Device Identification (UDI) systeemi. UDI:n tarkoitus on lisätä lääkinnällisten laitteiden seurattavuutta markkinoillesaattamisen jälkeen ja antaa laitteille valmistajan uniikki tunniste. (GS1 n.d.)
Laitevaatimusten tiukentuessa on myös eri alueilla kuten EU:ssa ja U.S:ssa valmiita suunnitelmia globaalisen tarpeen tai pandemian takia väliaikaisesti nopeuttaa tai helpottaa tarvittavien lääkinnällisten laitteiden tutkimusta ja valmistusta, silti varmistaen potilaiden turvallisuus ja laitteiden toimivuus. 3D-tulostetuilla lääkinnällisillä laitteilla on myös mahdollisuus saada matalampi riskiluokitus, jos ne ovat valmistettu tarkkaan potilaalle eli personoitu ja näin ollen varmistettu toimivuus tietyn potilaan mukaan ja vain hänen käyttöön, mutta tämä tulkitaan melkein aina tapauskohtaisesti. (EMA n.d.)
Regulaatioiden ja riskiluokitusten harmonisoinnin tapahtuessa on iso työ yhdistää käytäntöjä, sillä eri alueilla ja mailla voi olla jo hyvin hankala asia esim. asioiden nimeäminen tai ristikkäiset termit, mikä voi olla, yllättävää kyllä, jo kompastuskivi dokumenttien luomisessa tai luokitusten yhdistämisessä. Tämä voi vaatia tarkkojen termien implementointia jo tutkimus- tai tuotekehitysvaiheessa, jos globaaliseen harmonisointiin tähdätään. (Pettersson, A.B. ym. 2023.)
Kuinka toimia, jos haluaa tuoda markkinoille 3D-tulostetun lääkinnällisen laitteen?
3D-tulostettavat lääkinnälliset laitteet ovat terveysalalla täynnä potentiaalia ja moni pieni organisaatio voi olla kiinnostunut aiheesta. Kannattaa jo tuotekehityksessä olla yhteydessä markkinoitavan alueen regulaatioelimiin, sillä jotkin elimet, kuten FDA, voivat pyytää rekisteröintiä paljon ennen, kuin tuote olisi tulossa markkinoille. Regulaatioelimien sivuilta voi myös löytyä käyttökelpoisia opasteita, joilla voi alustavasti määritellä omien laitteiden riskiluokitusta ja vaatimuksia esimerkiksi seurannassa. Lisäksi voi löytyä tietoa siitä, miten kauan rekisteröintiprosessi vie aikaa ja mitkä ovat rekisteröinnin dokumentti- ja datavaatimukset. Rekisteröinnit ja riskiluokitukset uusille lääkinnällisille laitteille voivat viedä aikaa, varsinkin isomman riskin omaavilla lääkinnällisillä laitteilla ja regulaatiopäivitysten aikana. (Vivek, D ym. 2019.)
Yrityksille tai organisaatioille, joilla ei ole aikaa tai henkilökuntaa itse tutkia regulaatioita, on myös mahdollista käyttää regulaatiokonsulttiyrityksiä, jotka auttavat selittämään ja rekisteröimään tuotetta. Oman maan regulaatioelimet ovat myös valmiita konsultoimaan ja neuvomaan asioissa, jotka askaruttavat, varsinkin paikallisesti päivittyvien regulaatioiden osalta. Varsinkin EU:n ja U.S:n. regulaatioelimet koettavat tehdä ahkeraa yhteistyötä lääkinnällisten laitteiden valmistajien sekä tutkijoiden kanssa, jotta uudet käytännöt tulisivat tutuiksi.
Aiheesta voi lukea lisää opinnäytetyössä, joka löytyy Theseuksesta.
Lähteet:
Tähtinen, H. 2023. Regulations concerning additive manufacturing – Theseus, Turun ammattikorkeakoulun opinnäytetyö.
Åbo Akademi University. n.d. Turku AMK projecti AMBioPharma. Haettu 10.10.2023.
Osoitteesta: https://www.abo.fi/en/project/ambiopharma/
EMA. n.d. Medical devices. Haettu 26.5.2023.
Osoitteesta: https://www.ema.europa.eu/en/human-regulatory/overview/medical-devices
Formlabs. n.d. Guide to 3D Printing Medical Devices: From Prototyping to Commercialization Haettu 18.11.2023.
Osoitteesta: https://formlabs.com/blog/3d-printing-medical-devices/
FDA. 2021. 3D Printing Medical Devices at the Point of Care: Discussion Paper. Haettu 18.11.2023.
Osoitteesta: https://www.fda.gov/medical-devices/3d-printing-medical-devices/3d-printing-medical-devices-point-care-discussion-paper
GS1. n.d. Unique Device Identification (UDI). Haettu 26.8.2023.
https://www.gs1.org/industries/healthcare/udi#udi-in-the-eu
Pettersson, A.B.; Ballardini, R.M.; Mimler, M; Li, P; Salmi, M; Minssen, T; Gibson, I & Mäkitie, A. 2023. Legal issues and underexplored data protection in medical 3D printing: a scoping review. Haettu 15.10.2023.
Osoitteesta: https://aaltodoc.aalto.fi/handle/123456789/120011
Vivek, D; Sachdev, Y; Bhawna, G; Nikita, G & Rakesh, Y. 2019. Current Scenario of regulation and monitoring of medical devices in global realms of world. Haettu 30.6.2023.
Osoitteesta: https://www.asianhhm.com/technology-equipment/current-scenario-regulation-monitoring-medical-devices